2+4=2 Единственное оружие в борьбе с антибиотикорезистентностью
07.07.20202+4=2
Два типа антибиотикорезистентности
В процессе природного отбора бактерии развили различные приспособительные механизмы. В науке их объединяют термином естественная резистентность.
Появление противомикробных препаратов отрыло новую страницу в истории человечества – развитие хирургии, увеличение рождаемости и продолжительности жизни. Для бактериального мира индустрия противомикробных препаратов открыла новый фронт борьбы за выживание, на котором победителями становятся лидеры развития приобретенной резистентности.
|
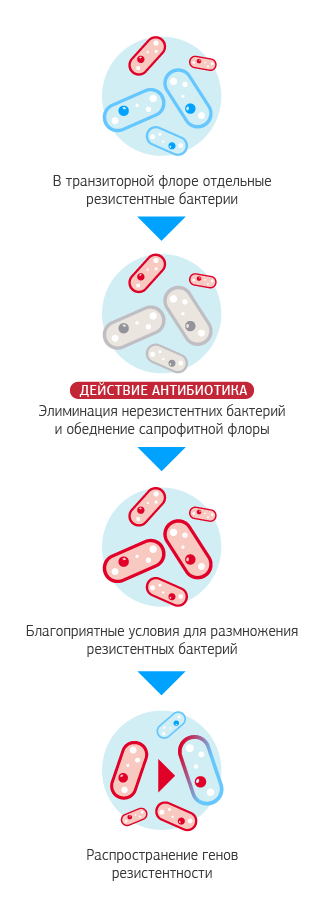
Естественная антибиотикорезистентность Естественная антибиотикорезистентность - отсутствие у микроорганизмов мишени для действия антибиотика или недоступности мишени вследствие первично низкой проницаемости или ферментативной инактивации. Например, Pseudomonas aeruginosa является естественно стойкой ко многим антибиотикам. Приобретенная антибиотикорезистентность Приобретенная антибиотикорезистентность - свойство отдельных штаммов бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют основную часть микробной популяции.
|
 |
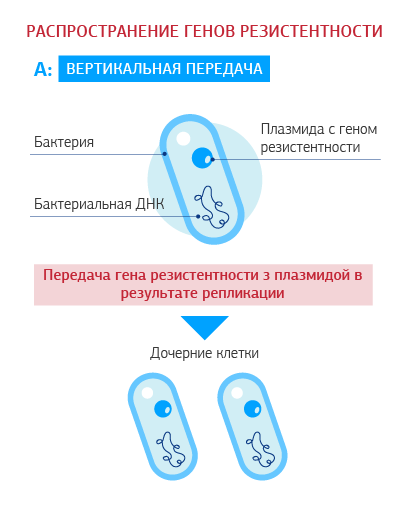
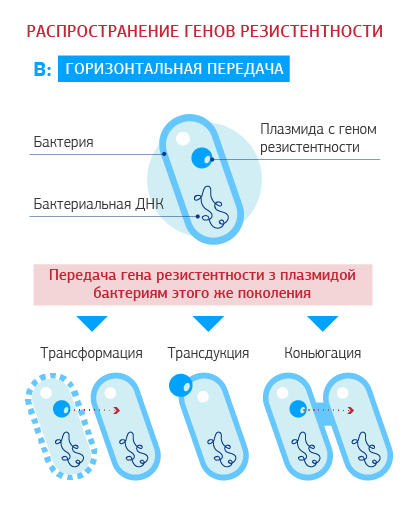
Как распространяется приобретенная резистентность?
Приобретенная антибиотикорезистентность развивается путем формирования мутаций (резистентный клон) или получения измененного генетического материала от других бактерий своего или другого вида (горизонтальное внутри- или межвидовое распространение). Гены резистентности расположены на мобильных элементах – плазмидах (отдельных от хромосомных молекулах ДНК, способных к автономной репликации) или на транспозонах (мобильных ДНК-последовательностях, способных перемещаться в геноме).
|
|
|
2+4=2
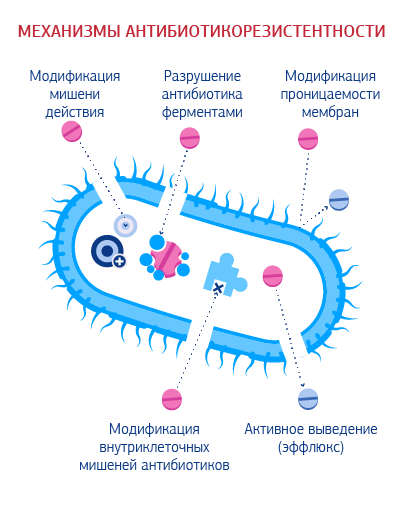
Четыре основных механизма развития приобретенной антибиотикорезистентности
|
 |
 |
Исследования показали, что использование антибиотиков расширенного спектра просто с целью «перекрыть» возможное наличие антибиотикорезистентных патогенов не только способствует развитию резистентности, но и повышает смертность от тяжелых инфекций4-6. |
Маркеры резистентности – новое оружие в лечении и контроле распространения антибиотикорезистентных штаммов
Автоматизация микробиологических исследований обеспечивает на только быструю видовую идентификацию широкого спектра возбудителей, но и одновременную оценку антибиотикочувствительности и маркеров резистентности.
Автоматизированный бакпосев в ДІЛА – это возможность определения всех доступных маркеров резистентности:
- бета-лактамазы расширенного спектра (ESBL);
- резистентность Staphylococcus spp. и Streptococcus spp. к макролидам, линкозамидам, стрептограминам (Efflux/MLSb);
- метициллин-резистентный Staphylococcus aureus (MRSA);
- резистентность Staphylococcus aureus, обусловленная геном mecA (mecA);
- для рода Staphylococcus штаммы, продуцирющие β-лактамазу (BL);
- резистентность и промежуточная резистентность Staphylococcus aureus к ванкомицину (VRSA, VISA);
- резистентность та промежуточная резистентность Staphylococcus aureus к тейкопланину (TISA, TRSA);
- резистентность Enterococcus spp. к ванкомицину (VRE) та тейкопланину (TRE);
- резистентность высокого уровня к аминогликозидам (HLAR); резистентность высокого уровня Staphylococcus aureus к мупироцину;
- продукция карбапенемаз.
2+4=2
Две составляющие эффективного лечения
- антибиотикочувствительность – уверенность в эффективности препарата, возможность сужения спектра и выбора препаратов резерва;
- маркеры резистентности – возможность индивидуального подбора терапевтических комбинаций при мультирезистентных возбудителях.
Например, нечувствительность энтеробактерий к карбапенемам может быть обусловлена:
- снижением проницаемости мембраны и бета-лактамазами со слабой активностью по отношению к карбапенемам (маркери AmpC або CTX-M) – нет горизонтальной передачи генов резистентности, вероятность передачи резистентного клона другим пациентам низка, выживаемость таких бактерий низка.
ИЛИ
- экспрессией истинных карбапенемаз (маркеры KPC, IMP, VIM, OXA) – закодированы в плазмидах, активная горизонтальная передача генов резистентности, часто мульти/панантибиотикорезистентны, вероятность передачи резистентного клона другим пациентам или медработникам высока.
 |
В стационаре и после выписки пациентам с антибиотикорезистентными возбудителями, продуцирующими истинные карбапенемазы, необходимо дать рекомендации по поведению для ограничения распространения этих микроорганизмов. Возможно обследование родственников на носительство резистентных штаммов7. |
| Резистентность к карбапенемам в результате непроницаемости мембраны | Резистентность к карбапенемам в результате продукции карбапенемаз |
| Нет горизонтального трансфера | Активный горизонтальных трансфер |
| Выживаемость клона снижена | Выживаемость клона высока |
| Вероятность передачи контактным лицам низкая | Вероятность передачи контактным лицам высокая – нужны эпидемиологические меры |
| Как правило НЕ мультирезистентны | Часто мульти- и панрезистентны |
| Комбинированные панели чувствительности автоматизированного бакпосева позволяют выбрать эффективный антибиотик | Комбинированные панели чувствительности автоматизированного бакпосева позволяют сформировать комбинацию препаратов (колистин, аминогликозиды, тигециклин) |
Выводы:
- Антибиотикорезистентность распространена. Это проблема актуальна для всех.
- Эффективное лечение инфекций, вызванных антибиотикорезистентными микроорганизмами, возможно при наличии данных про чувствительность к препаратам резерва и маркеры резистентности.
- Автоматизированная микробиология в ДІЛА – видовая идентификация широкого спектра патогенов с одновременным определением антибиотикочувствительности и маркеров резистентности в течение 3х суток.
 |
Не пропустите наше следующее сообщение про современные принципы антибактериальной терапии. |
Источники:
1. https://www.who.int/news-room/detail/01-06-2020-record-number-of-countries-contribute-data-revealing-disturbing-rates-of-antimicrobial-resistance
2. https://www.cdc.gov/drugresistance/pdf/threats-report/2019-ar-threats-report-508.pdf
3. Surveillance of antimicrobial resistance in Europe 2018
4. Rhee, Chanu, et al. "Prevalence of antibiotic-resistant pathogens in culture-proven sepsis and outcomes associated with inadequate and broad-spectrum empiric antibiotic use." JAMA Network Open 3.4 (2020)
5. Falagas ME, Lourida P, Poulikakos P, Rafailidis PI, Tanarli GS. Antibiotic treatment of infections due to carbapenem-resistant Enterobacteriaceae; systematic evaluation of the available evidence. Antimicrob Agents Chemother 2014
6. Temkin E, Adler A, Lerner A, Carmeli Y. Carbapenem-resistant Enterobacteriaceae: biology, epidemiology and management. Ann NY Acad Sci USA 2014
7. Bonomo, Robert A., et al. "Carbapenemase-producing organisms: a global scourge." Clinical Infectious Diseases 66.8 (2018)
8. https://today.duke.edu/2015/01/superbug